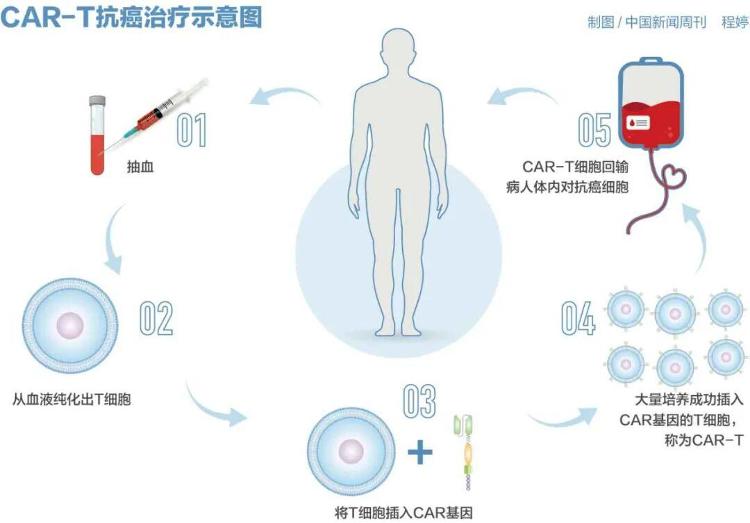
商业保险将包含价值100万元的抗癌药物。 10月底,国家医疗保障局举行2025年国家基本医疗保险药品目录谈判和商业保险创新药品目录价格谈判。该谈判首次在商业保险药品创新目录中引入。据现场报道,价格谈判结束后,天津和源生物科技有限公司的谈判人员显然对结果持乐观态度。公司的“Nachiolense”是国内首款用于治疗白血病的CAR-T产品。价格为每次使用99.9万元,是国产CAR-T产品中价格最低的。 CAR-T疗法是一种嵌合抗原受体T细胞免疫疗法。这种治疗涉及对从患者或捐赠者收集的免疫细胞进行基因改造,并为其配备精确的导航系统可以识别癌细胞的免疫系统(CAR)。这种增强的免疫力在重新注射到患者体内后能够精确有效地破坏癌细胞。目前,国家药监局共批准8个CAR-T产品在国内销售,其中大部分单针售价高达100万元。 “CAR-T疗法正在走向低成本、低风险。”中国科学技术大学第一附属医院风湿免疫科主任陈竺告诉《中国新闻周刊》。他和他的团队最近进行了CAR-T治疗系统性红斑狼疮的临床研究,并取得了重大进展。该成果于今年9月发表在国际期刊《新英格兰医学杂志》上。然而,从数百万美元的价格到实惠的价格,CAR-T 疗法需要的不仅仅是创新。今年9月,S国务院颁布《生物医学新技术临床研究和临床转化应用管理规定》,将于明年5月1日起施行。该法规旨在规范生物医学新技术的临床研究和转化应用,被称为细胞治疗等前沿治疗的“基本法”。有了制度保障和限制,CAR-T疗法能否走上新的高速轨道? “精确导航”治疗 自身免疫性疾病通常被描述为体内的“叛乱”。以系统性红斑狼疮(SLE)为例,症状患者最有特征的临床症状是面部蝴蝶状红斑。应该攻击外敌。人体的免疫系统将自身的血管视为敌人并对其进行攻击,从而在身体表面造成溃疡和伤口。根据国家杂志发表的流行病学研究北京协和医科大学医院风湿免疫科2024年《科学杂志》指出,SLE在育龄女性中更为常见,在日本发病率逐年上升。免疫系统叛乱的原因尚不清楚。陈竺多年来一直研究SLE发病机制。他告诉《中国新闻周刊》,系统性红斑狼疮是一种典型的自身免疫性疾病。目前只知道患者的免疫系统异常激活,但具体机制尚不清楚。当系统性红斑狼疮的确切病因不明时,系统性红斑狼疮的传统治疗方法是对症治疗,通过抑制免疫系统功能来减轻症状。最常用的治疗药物是糖皮质激素和免疫抑制剂。陈竺指出,由于没有治疗方法,病人一旦停药,病情就会复发。长期使用可能会使药物对某些患者的疗效降低。此外,荷尔蒙es和免疫抑制剂往往有副作用,并不是“长期解决方案”。随着CAR-T疗法的出现,这种情况发生了改变。 2012年,一位名叫艾米丽(Emily)的患有急性淋巴细胞白血病的女孩在美国接受治疗,目前仍然健康状况良好。 2017年,美国食品药品监督管理局(FDA)牵头批准了针对血液恶性肿瘤的CAR-T疗法。国内同类药物预计在2021年首次获批。找到一种方法来准确识别“敌人”是CAR-T疗法的关键。多项临床研究证实,它能有效消除组织器官中的B细胞。陈竺指出,B细胞清除得越彻底,疾病长期缓解的机会就越大。为什么CAR-T细胞如此有效?陈竺解释说,传统的CAR-T疗法需要从人体血液中提取并培养T细胞。这些耗尽的 T 细胞经过一系列体外处理,并被通过基因编辑和其他方式生产癌症相关抗原。然后在注射到患者体内之前对其进行培养、扩增和测试。这些超级细胞配备了“肿瘤定位导航”,可以让您精确识别和杀死孢子。然而,这个过程存在明显的问题。不少受访者指出,患者在回输前必须接受一系列准备措施,包括停用免疫抑制剂、减少激素剂量、等待体外T细胞培养等。整个过程可能需要两周到一个月的时间。这也意味着一些重症患者等不起。此外,陈竺了解到,大多数研究项目都要求患者进行预处理,比如在治疗前使用药物切除淋巴结,这相当于削弱了人体的免疫防线,增加了感染风险。我们该如何解决这个问题呢?同质大学通用 CAR-T 是一个想法。去年7月,上海方药生物科技有限公司(以下简称方药生物)与上海长征医院合作,研发新一代通用同种异体CAR-T疗法。 3名复发难治性自身免疫性疾病患者接受该疗法后,症状明显改善。该成果发表在《Cell》杂志上,并被评选为年度最佳《Cell》文章。华东师范大学生物医学科学研究所所长、邦耀生物创始人刘明耀是该论文的通讯作者之一。他告诉《中国新闻周刊》,目前国内外批准的CAR-T疗法都是自体CAR-T,即采集、改造和培养患者自身的T细胞。然而,大多数癌症患者此前接受过放疗或化疗,他们的T细胞存在很多缺陷。同种异体CAR-T获得T细胞来自年轻、健康的捐赠者,因此它的功能显然更强大。然而,同种异体CAR-T需要解决两个主要问题。首先,同种异体 T 细胞攻击患者的健康组织和器官,引发强烈的免疫反应。其次,患者对异体细胞的免疫排斥反应。邦耀生物自2016年起就一直在解决同种异体T细胞排斥的问题。刘明耀回忆,团队利用基因编辑技术删除或添加某些基因,使同种异体T细胞能够在患者体内正常生长。 Yu于2018年生产了第一批Niversal CAR-T细胞,但一投入临床实践,就发现分析的患者中免疫排斥反应非常明显。 “只有患者的身体才能告知排斥反应的具体情况。”经过八年多迭代,刘明耀团队终于证明同种异体CAR-T可以预防患者排斥反应并且不会引起强烈的免疫反应。在刘明耀看来,同种异体CAR-T的主要优势之一是可以在体外扩增一个T细胞,制备成百上千种“救命药”。与常规细胞药物一样,同种异体 CAR-T 可以储存在冰箱中并在任何地方使用。他说,另一个想法是将体外T细胞转化过程转移到患者体内,并指出传统的体外T细胞转化通常只需要几个小时就可以直接在体内组装CAR T细胞。美国吉利德科学公司旗下的大型CAR-T公司比利时EsoBiotec公司于8月收购了一家专门从事体内CAR-T疗法的私营生物技术公司,并正在进行100万元至10万元的技术改造。刘明耀表示,这也是技术创新的目标。目前,尚无正式批准用于治疗自身免疫性疾病的CAR-T疗法。全世界。刘明耀表示,邦耀生物研发的同种异体CAR-T疗法主要有两个适应症。一是血液恶性肿瘤,包括白血病、淋巴瘤,相应项目已获得国家药监局两项临床批件,正式开始招募患者进行临床试验。另一个是SLE、坏死性肌炎等自身免疫性疾病,相应的项目正处于临床前研究阶段。许多受访者指出,虽然CAR-T疗法的整体疗效与传统药物一样重要,但它也因人而异。陈竺强调,非处方药并不是100%有效,因此强调需要进行临床试验,以在尽可能大的人群中确认疗效。图/华东师范大学公众号 CAR-T疗法适合尚未获得充分治疗的患者常规治疗后有缓解,或已出现缓解但多次复发的患者。陈竺对此表示,他指出不能作为一线治疗选择。传统医学至少有几十年的临床经验。如果标准治疗计划无效,您的医生可能会考虑逐步更新您的治疗方案。只有经过长期实践形成标准化的治疗方案,才能将CAR-T疗法作为一线治疗选择进行讨论。从适应症角度来看,CAR-T疗法的优势仍然存在于血液肿瘤领域。尽管自身免疫性疾病领域已经取得了进展,但将其应用于胃癌和胰腺癌等实体瘤仍然存在困难。陈竺表示,现有的CAR-T疗法对于大多数实体瘤的疗效非常有限,原因尚不清楚。为了使细胞发挥作用,它必须在遇到目标细胞后激活并分裂,产生培养更多的T细胞,以彻底“消灭”“敌人”。一种可能是实体瘤的局部环境不利于CAR-T细胞增殖。越来越多的研究关注操纵 T 细胞的新方法。虽然这涉及到更复杂的免疫学原理,但陈竺相信是有可能克服的。刘明耀团队也在研究基因编辑与实体瘤CAR-T的结合。他认为,未来五年我们将看到实体瘤领域取得巨大进展。 CAR-T疗法的批准是在保证有效性的基础上确定安全性的。 2016年,魏则西接受了不恰当、不成熟的细胞免疫治疗,导致症状迟发并死亡。国内和国际研究中报告的最常见的副作用是细胞因子释放综合征,也称为“细胞因子风暴”。 “即使是体内CAR-T疗法也无法完全避免这场风暴。”陈竺坦言。当CAR-T细胞进入临床与靶细胞接触,它们被激活并产生细胞因子。这些因素会引起体内炎症反应,表现为发烧或高烧。如果炎症因子长时间保持在高水平,可能会导致多器官衰竭,严重时甚至导致死亡。细胞因子风暴在血液肿瘤中更为常见,其严重程度与B淋巴细胞的数量有关。它已连接。陈竺接着说,SLE也含有B淋巴细胞,但数量较少,副作用也相对轻微。临床上已观察到患者24小时内退烧,发生率较低,但长期安全性尚未得到证实。同时,治疗前使用抗过敏、抗炎药物可以明显减轻风暴。刘明耀团队已治疗了20多名自身免疫性疾病患者。虽然没有完全阻止,但更严重的细胞因子风暴尚未出现服务。他指出,同种异体CAR-T比传统自体CAR-T副作用更少。价格一直是 CAR-T 疗法的主要缺点。上海一位从事细胞免疫治疗研究的学者告诉《中国新闻周刊》,目前国内批准的体外CAR-T药物价格在100万安杜以上,而美国FDA批准的同类药物价格在几十万到20万美元之间。由于价格昂贵,其受欢迎程度受到限制。今年,CAR-T疗法首次超过国家医保谈判标准。购买商业保险将会改善这种情况。陈竺表示,CAR-T药物在体内的成本明显低于自体CAR-T药物。作为基因转移的载体,大规模生产工艺已经成熟,仅制造成本就可以降低十分之几,有时甚至可以降低百分之一。刘明耀也表示,同种异体CAR-T可以治疗将个性化治疗方案变成真正的商品化药物,将总成本从100万元降低到10万元以内,并且极有可能实现平价。不仅仅是一根简单的“救命稻草”,陈竺团队的体内CAR-T药物研究目前已进入I期临床阶段。 “5名患有复发难治性SLE的女性参加了I期临床试验,主要目的是考察药物的安全性。在安全性的基础上,我们观察疗效。根据SLE治疗指南,疗效观察期通常为3个月。II期只有在有初步疗效的情况下才适用。”陈竺将支持II期和III期临床试验,进一步测试药物在更大人群中的疗效。他表示有必要扩大样本。从2012年首例患者到2017年获得批准,CAR-T药物一直被认为是快速上市的领导者。陈竺认为,许多无法治愈的疾病CAR-T针对的对象没有标准的治疗方案,研究样本量仍然较小,且伦理问题导致临床试验难以进行。 “不到100名患者的临床研究可以加速CAR-T药物的批准。研究显示,第一家开发针对自身免疫性疾病的CAR-T疗法的药企可以在三年内获得批准,但在中国可能需要五年时间,这表明了行业共识。创新药物的开发从发现靶向药物到商业化平均需要10年时间,花费10亿美元,但针对SLE的生物药物tatacept在2017年获批上市。中国去年,2023年开始临床前研究,制定临床研究计划,2024年底提交审评报告。三个月后,今年年初,陈竺表示,伦理审查也是一个措施,需要监管部门的批准,而细胞治疗药物,在原则上,需要医院和省伦理委员会两步审批和申请。卫生局编辑刘明耀表示,虽然基因编辑的同种异体CAR-T在短期内解决了免疫排斥问题,但外源CAR-T细胞在体内最多可以存活3至6个月,最终因排斥而失效。 “我们努力了8年,才实现了3到6个月的不拒绝,但在使用基因编辑技术的伦理审查中,我们却多次被问及伦理风险。”刘明耀说。他指出,由于基因编辑药物数量较少,鉴定和评估的专家资源相对较少,监管部门普遍面临审查权力不足的问题。如果该请求是该领域的首个药物,监管机构将更加关注细节,从而使该公司的申请更有可能被拒绝。比如在供应链上,刘明耀一直有亲和力。原材料交换问题。监管机构现在对原材料的控制非常严格。 “就细胞药物而言,一些原材料在细胞培养或合成后就不再存在。与合成小分子药物不同,原材料成为小分子药物的一部分。”然而,监管机构可能会认为,由于某种特定蛋白质是核心成分,因此即使该蛋白质最终没有被取代,也必须被取代。就细胞药物而言,仍需要进行多项研究和证据收集来证明原材料的变化不会影响功效和药物安全性。 “这影响了发展速度。”刘明耀表示。在他看来,即使企业与临床团队合作开发出全球最先进的技术,有可能降低CAR-T疗法的价格,但仍很难推动产业化。在当前的金融环境下,投资者“不敢再投资”。另外,基因治疗和细胞治疗仍然在国家发改委的“市场准入负面清单”上。换句话说,这意味着以下几点。尽管如此,细胞治疗近年来取得了前所未有的进展,今年4月,北京地坛医院将开展免疫治疗、筛查临床试验等相关临床服务,填补了省内细胞治疗领域的空白。记者注意到,虽然全国已有100多家医院注册了随着国家卫健委正式纳入为各类疾病提供诊疗服务的细胞治疗临床研究部门,CAR-T疗法仍面临着从技术进步到常规治疗的挑战,将这种创新疗法从“救命稻草”转变为患者日常治疗选择不仅需要。科技的进步,还有与基本医疗、商业保险融合的支付体系。监管支持。
商业保险将包含价值100万元的抗癌药物。 10月底,国家医疗保障局举行2025年国家基本医疗保险药品目录谈判和商业保险创新药品目录价格谈判。该谈判首次在商业保险药品创新目录中引入。据现场报道,价格谈判结束后,天津和源生物科技有限公司的谈判人员显然对结果持乐观态度。公司的“Nachiolense”是国内首款用于治疗白血病的CAR-T产品。价格为每次使用99.9万元,是国产CAR-T产品中价格最低的。 CAR-T疗法是一种嵌合抗原受体T细胞免疫疗法。这种治疗涉及对从患者或捐赠者收集的免疫细胞进行基因改造,并为其配备精确的导航系统可以识别癌细胞的免疫系统(CAR)。这种增强的免疫力在重新注射到患者体内后能够精确有效地破坏癌细胞。目前,国家药监局共批准8个CAR-T产品在国内销售,其中大部分单针售价高达100万元。 “CAR-T疗法正在走向低成本、低风险。”中国科学技术大学第一附属医院风湿免疫科主任陈竺告诉《中国新闻周刊》。他和他的团队最近进行了CAR-T治疗系统性红斑狼疮的临床研究,并取得了重大进展。该成果于今年9月发表在国际期刊《新英格兰医学杂志》上。然而,从数百万美元的价格到实惠的价格,CAR-T 疗法需要的不仅仅是创新。今年9月,S国务院颁布《生物医学新技术临床研究和临床转化应用管理规定》,将于明年5月1日起施行。该法规旨在规范生物医学新技术的临床研究和转化应用,被称为细胞治疗等前沿治疗的“基本法”。有了制度保障和限制,CAR-T疗法能否走上新的高速轨道? “精确导航”治疗 自身免疫性疾病通常被描述为体内的“叛乱”。以系统性红斑狼疮(SLE)为例,症状患者最有特征的临床症状是面部蝴蝶状红斑。应该攻击外敌。人体的免疫系统将自身的血管视为敌人并对其进行攻击,从而在身体表面造成溃疡和伤口。根据国家杂志发表的流行病学研究北京协和医科大学医院风湿免疫科2024年《科学杂志》指出,SLE在育龄女性中更为常见,在日本发病率逐年上升。免疫系统叛乱的原因尚不清楚。陈竺多年来一直研究SLE发病机制。他告诉《中国新闻周刊》,系统性红斑狼疮是一种典型的自身免疫性疾病。目前只知道患者的免疫系统异常激活,但具体机制尚不清楚。当系统性红斑狼疮的确切病因不明时,系统性红斑狼疮的传统治疗方法是对症治疗,通过抑制免疫系统功能来减轻症状。最常用的治疗药物是糖皮质激素和免疫抑制剂。陈竺指出,由于没有治疗方法,病人一旦停药,病情就会复发。长期使用可能会使药物对某些患者的疗效降低。此外,荷尔蒙es和免疫抑制剂往往有副作用,并不是“长期解决方案”。随着CAR-T疗法的出现,这种情况发生了改变。 2012年,一位名叫艾米丽(Emily)的患有急性淋巴细胞白血病的女孩在美国接受治疗,目前仍然健康状况良好。 2017年,美国食品药品监督管理局(FDA)牵头批准了针对血液恶性肿瘤的CAR-T疗法。国内同类药物预计在2021年首次获批。找到一种方法来准确识别“敌人”是CAR-T疗法的关键。多项临床研究证实,它能有效消除组织器官中的B细胞。陈竺指出,B细胞清除得越彻底,疾病长期缓解的机会就越大。为什么CAR-T细胞如此有效?陈竺解释说,传统的CAR-T疗法需要从人体血液中提取并培养T细胞。这些耗尽的 T 细胞经过一系列体外处理,并被通过基因编辑和其他方式生产癌症相关抗原。然后在注射到患者体内之前对其进行培养、扩增和测试。这些超级细胞配备了“肿瘤定位导航”,可以让您精确识别和杀死孢子。然而,这个过程存在明显的问题。不少受访者指出,患者在回输前必须接受一系列准备措施,包括停用免疫抑制剂、减少激素剂量、等待体外T细胞培养等。整个过程可能需要两周到一个月的时间。这也意味着一些重症患者等不起。此外,陈竺了解到,大多数研究项目都要求患者进行预处理,比如在治疗前使用药物切除淋巴结,这相当于削弱了人体的免疫防线,增加了感染风险。我们该如何解决这个问题呢?同质大学通用 CAR-T 是一个想法。去年7月,上海方药生物科技有限公司(以下简称方药生物)与上海长征医院合作,研发新一代通用同种异体CAR-T疗法。 3名复发难治性自身免疫性疾病患者接受该疗法后,症状明显改善。该成果发表在《Cell》杂志上,并被评选为年度最佳《Cell》文章。华东师范大学生物医学科学研究所所长、邦耀生物创始人刘明耀是该论文的通讯作者之一。他告诉《中国新闻周刊》,目前国内外批准的CAR-T疗法都是自体CAR-T,即采集、改造和培养患者自身的T细胞。然而,大多数癌症患者此前接受过放疗或化疗,他们的T细胞存在很多缺陷。同种异体CAR-T获得T细胞来自年轻、健康的捐赠者,因此它的功能显然更强大。然而,同种异体CAR-T需要解决两个主要问题。首先,同种异体 T 细胞攻击患者的健康组织和器官,引发强烈的免疫反应。其次,患者对异体细胞的免疫排斥反应。邦耀生物自2016年起就一直在解决同种异体T细胞排斥的问题。刘明耀回忆,团队利用基因编辑技术删除或添加某些基因,使同种异体T细胞能够在患者体内正常生长。 Yu于2018年生产了第一批Niversal CAR-T细胞,但一投入临床实践,就发现分析的患者中免疫排斥反应非常明显。 “只有患者的身体才能告知排斥反应的具体情况。”经过八年多迭代,刘明耀团队终于证明同种异体CAR-T可以预防患者排斥反应并且不会引起强烈的免疫反应。在刘明耀看来,同种异体CAR-T的主要优势之一是可以在体外扩增一个T细胞,制备成百上千种“救命药”。与常规细胞药物一样,同种异体 CAR-T 可以储存在冰箱中并在任何地方使用。他说,另一个想法是将体外T细胞转化过程转移到患者体内,并指出传统的体外T细胞转化通常只需要几个小时就可以直接在体内组装CAR T细胞。美国吉利德科学公司旗下的大型CAR-T公司比利时EsoBiotec公司于8月收购了一家专门从事体内CAR-T疗法的私营生物技术公司,并正在进行100万元至10万元的技术改造。刘明耀表示,这也是技术创新的目标。目前,尚无正式批准用于治疗自身免疫性疾病的CAR-T疗法。全世界。刘明耀表示,邦耀生物研发的同种异体CAR-T疗法主要有两个适应症。一是血液恶性肿瘤,包括白血病、淋巴瘤,相应项目已获得国家药监局两项临床批件,正式开始招募患者进行临床试验。另一个是SLE、坏死性肌炎等自身免疫性疾病,相应的项目正处于临床前研究阶段。许多受访者指出,虽然CAR-T疗法的整体疗效与传统药物一样重要,但它也因人而异。陈竺强调,非处方药并不是100%有效,因此强调需要进行临床试验,以在尽可能大的人群中确认疗效。图/华东师范大学公众号 CAR-T疗法适合尚未获得充分治疗的患者常规治疗后有缓解,或已出现缓解但多次复发的患者。陈竺对此表示,他指出不能作为一线治疗选择。传统医学至少有几十年的临床经验。如果标准治疗计划无效,您的医生可能会考虑逐步更新您的治疗方案。只有经过长期实践形成标准化的治疗方案,才能将CAR-T疗法作为一线治疗选择进行讨论。从适应症角度来看,CAR-T疗法的优势仍然存在于血液肿瘤领域。尽管自身免疫性疾病领域已经取得了进展,但将其应用于胃癌和胰腺癌等实体瘤仍然存在困难。陈竺表示,现有的CAR-T疗法对于大多数实体瘤的疗效非常有限,原因尚不清楚。为了使细胞发挥作用,它必须在遇到目标细胞后激活并分裂,产生培养更多的T细胞,以彻底“消灭”“敌人”。一种可能是实体瘤的局部环境不利于CAR-T细胞增殖。越来越多的研究关注操纵 T 细胞的新方法。虽然这涉及到更复杂的免疫学原理,但陈竺相信是有可能克服的。刘明耀团队也在研究基因编辑与实体瘤CAR-T的结合。他认为,未来五年我们将看到实体瘤领域取得巨大进展。 CAR-T疗法的批准是在保证有效性的基础上确定安全性的。 2016年,魏则西接受了不恰当、不成熟的细胞免疫治疗,导致症状迟发并死亡。国内和国际研究中报告的最常见的副作用是细胞因子释放综合征,也称为“细胞因子风暴”。 “即使是体内CAR-T疗法也无法完全避免这场风暴。”陈竺坦言。当CAR-T细胞进入临床与靶细胞接触,它们被激活并产生细胞因子。这些因素会引起体内炎症反应,表现为发烧或高烧。如果炎症因子长时间保持在高水平,可能会导致多器官衰竭,严重时甚至导致死亡。细胞因子风暴在血液肿瘤中更为常见,其严重程度与B淋巴细胞的数量有关。它已连接。陈竺接着说,SLE也含有B淋巴细胞,但数量较少,副作用也相对轻微。临床上已观察到患者24小时内退烧,发生率较低,但长期安全性尚未得到证实。同时,治疗前使用抗过敏、抗炎药物可以明显减轻风暴。刘明耀团队已治疗了20多名自身免疫性疾病患者。虽然没有完全阻止,但更严重的细胞因子风暴尚未出现服务。他指出,同种异体CAR-T比传统自体CAR-T副作用更少。价格一直是 CAR-T 疗法的主要缺点。上海一位从事细胞免疫治疗研究的学者告诉《中国新闻周刊》,目前国内批准的体外CAR-T药物价格在100万安杜以上,而美国FDA批准的同类药物价格在几十万到20万美元之间。由于价格昂贵,其受欢迎程度受到限制。今年,CAR-T疗法首次超过国家医保谈判标准。购买商业保险将会改善这种情况。陈竺表示,CAR-T药物在体内的成本明显低于自体CAR-T药物。作为基因转移的载体,大规模生产工艺已经成熟,仅制造成本就可以降低十分之几,有时甚至可以降低百分之一。刘明耀也表示,同种异体CAR-T可以治疗将个性化治疗方案变成真正的商品化药物,将总成本从100万元降低到10万元以内,并且极有可能实现平价。不仅仅是一根简单的“救命稻草”,陈竺团队的体内CAR-T药物研究目前已进入I期临床阶段。 “5名患有复发难治性SLE的女性参加了I期临床试验,主要目的是考察药物的安全性。在安全性的基础上,我们观察疗效。根据SLE治疗指南,疗效观察期通常为3个月。II期只有在有初步疗效的情况下才适用。”陈竺将支持II期和III期临床试验,进一步测试药物在更大人群中的疗效。他表示有必要扩大样本。从2012年首例患者到2017年获得批准,CAR-T药物一直被认为是快速上市的领导者。陈竺认为,许多无法治愈的疾病CAR-T针对的对象没有标准的治疗方案,研究样本量仍然较小,且伦理问题导致临床试验难以进行。 “不到100名患者的临床研究可以加速CAR-T药物的批准。研究显示,第一家开发针对自身免疫性疾病的CAR-T疗法的药企可以在三年内获得批准,但在中国可能需要五年时间,这表明了行业共识。创新药物的开发从发现靶向药物到商业化平均需要10年时间,花费10亿美元,但针对SLE的生物药物tatacept在2017年获批上市。中国去年,2023年开始临床前研究,制定临床研究计划,2024年底提交审评报告。三个月后,今年年初,陈竺表示,伦理审查也是一个措施,需要监管部门的批准,而细胞治疗药物,在原则上,需要医院和省伦理委员会两步审批和申请。卫生局编辑刘明耀表示,虽然基因编辑的同种异体CAR-T在短期内解决了免疫排斥问题,但外源CAR-T细胞在体内最多可以存活3至6个月,最终因排斥而失效。 “我们努力了8年,才实现了3到6个月的不拒绝,但在使用基因编辑技术的伦理审查中,我们却多次被问及伦理风险。”刘明耀说。他指出,由于基因编辑药物数量较少,鉴定和评估的专家资源相对较少,监管部门普遍面临审查权力不足的问题。如果该请求是该领域的首个药物,监管机构将更加关注细节,从而使该公司的申请更有可能被拒绝。比如在供应链上,刘明耀一直有亲和力。原材料交换问题。监管机构现在对原材料的控制非常严格。 “就细胞药物而言,一些原材料在细胞培养或合成后就不再存在。与合成小分子药物不同,原材料成为小分子药物的一部分。”然而,监管机构可能会认为,由于某种特定蛋白质是核心成分,因此即使该蛋白质最终没有被取代,也必须被取代。就细胞药物而言,仍需要进行多项研究和证据收集来证明原材料的变化不会影响功效和药物安全性。 “这影响了发展速度。”刘明耀表示。在他看来,即使企业与临床团队合作开发出全球最先进的技术,有可能降低CAR-T疗法的价格,但仍很难推动产业化。在当前的金融环境下,投资者“不敢再投资”。另外,基因治疗和细胞治疗仍然在国家发改委的“市场准入负面清单”上。换句话说,这意味着以下几点。尽管如此,细胞治疗近年来取得了前所未有的进展,今年4月,北京地坛医院将开展免疫治疗、筛查临床试验等相关临床服务,填补了省内细胞治疗领域的空白。记者注意到,虽然全国已有100多家医院注册了随着国家卫健委正式纳入为各类疾病提供诊疗服务的细胞治疗临床研究部门,CAR-T疗法仍面临着从技术进步到常规治疗的挑战,将这种创新疗法从“救命稻草”转变为患者日常治疗选择不仅需要。科技的进步,还有与基本医疗、商业保险融合的支付体系。监管支持。